Fibrose is een van de hardnekkigste vraagstukken binnen de medische wereld. Deze pathologische vorm van littekenvorming is betrokken bij 45 procent van de overlijdens in de geïndustrialiseerde wereld. En toch is het een proces dat we nog maar pas beginnen te begrijpen, met dank aan technologie. Ook in de zoektocht naar oplossingen zal technologie trouwens een rol spelen.
Fibrose komt in vele gedaantes, maar is betrokken bij quasi alle belangrijke gezondheidsproblemen van onze tijd. Vanaf wanneer wordt het proces van natuurlijke celregeneratie in littekenweefsel problematisch? Dat punt in de tijd is bijzonder moeilijk te bepalen.
Vast staat dat fibrose lang onder de radar kan blijven en vaak pas problematisch wordt wanneer het proces al zo ver gevorderd is dat onderliggende organen slecht beginnen functioneren: ademhalingsmoeilijkheden bij longfibrose, hartproblemen bij fibrose in het hart, chronische en vaak hevige gewrichtspijn bij osteoarthritis. Andere ziektes, zoals bijvoorbeeld diabetes, kunnen ook aanleiding vormen tot fibrose als secundaire aandoening. En in de vorming van kwaadaardige kankertumoren speelt fibrose eveneens een elementaire rol.
Wat veroorzaakt nu die malfunctie van organen? De reden is dat fibrose de zogeheten extracellulaire matrix, een dynamische gel van proteoglycanen, koolhydraten en eiwitmoleculen van samenstelling verandert en stijver maakt. Dat heeft een impact op een aantal cruciale mechanische eigenschappen, zoals de manier waarop voedingsstoffen, afvalstoffen en signaalstoffen door het weefsel verspreid kunnen worden. Tegelijk stuurt het ook de dedifferentiatie van de lokale cellen aan, het proces waarbij gespecialiseerde cellen hun specifieke kenmerken verliezen en terugkeren naar een meer primitieve toestand.
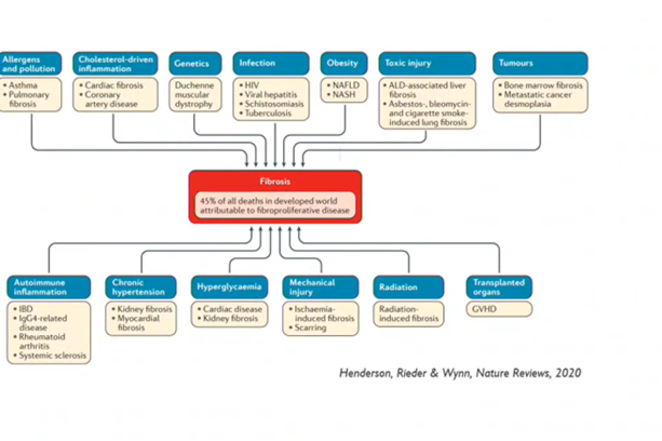
Fibrose vormt het onderliggende mechanisme bij een heel aantal belangrijke gezondheidsproblemen van onze tijd.
Fibrose ontcijferen
Maar hoe komt het eigenlijk dat het wondhelingsproces soms in overdrive gaat? Dat blijft onduidelijk. Onderzoekers die MR-scans van mucoviscidosepatiënten vergeleken met een controlegroep, merkten bij de patiënten acute ontstekingen in het brein op.
Dat suggereert een link tussen het zenuwstelsel enerzijds, en de getroffen organen anderzijds. Een spaakgelopen immuunsysteem vormt allicht de brug tussen zenuwstelsel en lokale schade. Het is met andere woorden geen louter lokaal, maar ook een systemisch probleem: het hele lichaam spant samen tegen het 'gewone' genezingsproces.
Als we fibrose willen ontcijferen, dan moeten we beter begrijpen hoe de complexe communicatie tussen celpopulaties en hun regulerende systemen verloopt, zodat we kunnen zien waar het precies misloopt in een vroege fase.
Vervolgens kunnen we dan gericht behandelingen ontwikkelen, bijvoorbeeld door heel specifiek te gaan stimuleren met elektrische signalen - dat is iets waarvan we weten dat het goed werkt bij het zenuwstelsel. Dat vergt dan wel een gedetailleerde blik op cellen en processen op het niveau van één cel.
De drietrapsraket van innovatieve chips, krachtige AI en knappe onderzoekers, is ons meest beloftevolle wapen tegen fibrose
Precies die uitdaging vormt het werk van de Zweedse professor Johanna Bolander, die zowel verbonden is aan imec als aan het gerenommeerde Charité universtair ziekenhuis in Berlijn. Bolander en haar onderzoeksteam gebruiken daarvoor op maat gemaakte versies van bestaande, innovatieve hardwaretechnologieën zoals de MEA-chips (Multi-Electrode Arrays).
MEA-chips laten toe om op celniveau signalen te capteren, er de ruis uit te filteren en vervolgens de analoge pulsen te vertalen in digitale data. Met 16.384 elektrodes en 1.024 uitleeskanalen op een oppervlakte van 250 vierkante millimeter leveren deze chips grote objectiviteit, verbluffende precisie en gigantisch veel kwaliteitsvolle data.

AI als versneller onderzoek
Maar hoe complexer een systeem is, hoe complexer de uitlezing wordt. Daarom is artificiële intelligentie nodig om die data snel uit te lezen, verbanden te leren en dat alles te vertalen in bruikbare inzichten. Het is alsof je niet met één onderzoeksgroep naar de data zit te kijken, maar met miljarden onderzoekers tegelijk. Hoe interageren cellen met elkaar? Hoe reageren ze op verschillende soorten stimuli?
Eens je die inzichten hebt, kan je met gerichte stimulatie het genezingsproces verbeteren. Tegelijk vormen AI-algoritmes een veelbelovende manier om fibrose sneller te detecteren via biomarkers of hints in medische scans. Dat is van groot belang, want hoe langer je wacht om fibrose te behandelen, hoe complexer, invasiever, duurder en minder succesvol de therapie wordt.
De drietrapsraket van innovatieve chips, krachtige AI en knappe onderzoekers, is ons meest beloftevolle wapen tegen het hardnekkige probleem dat fibrose vandaag is. Vast staat dat de potentiële winst aan gezonde levensjaren en het vermeden leed gigantisch is.

